Research 研究内容
分子遺伝医学分野では、遺伝子および細胞治療の基盤技術の開発を中心に、分子病態解析、遺伝診療、遺伝子・細胞治療の高度化を推進し、個別化ゲノム医療の包括的トランスレーショナルリサーチを目指しています。
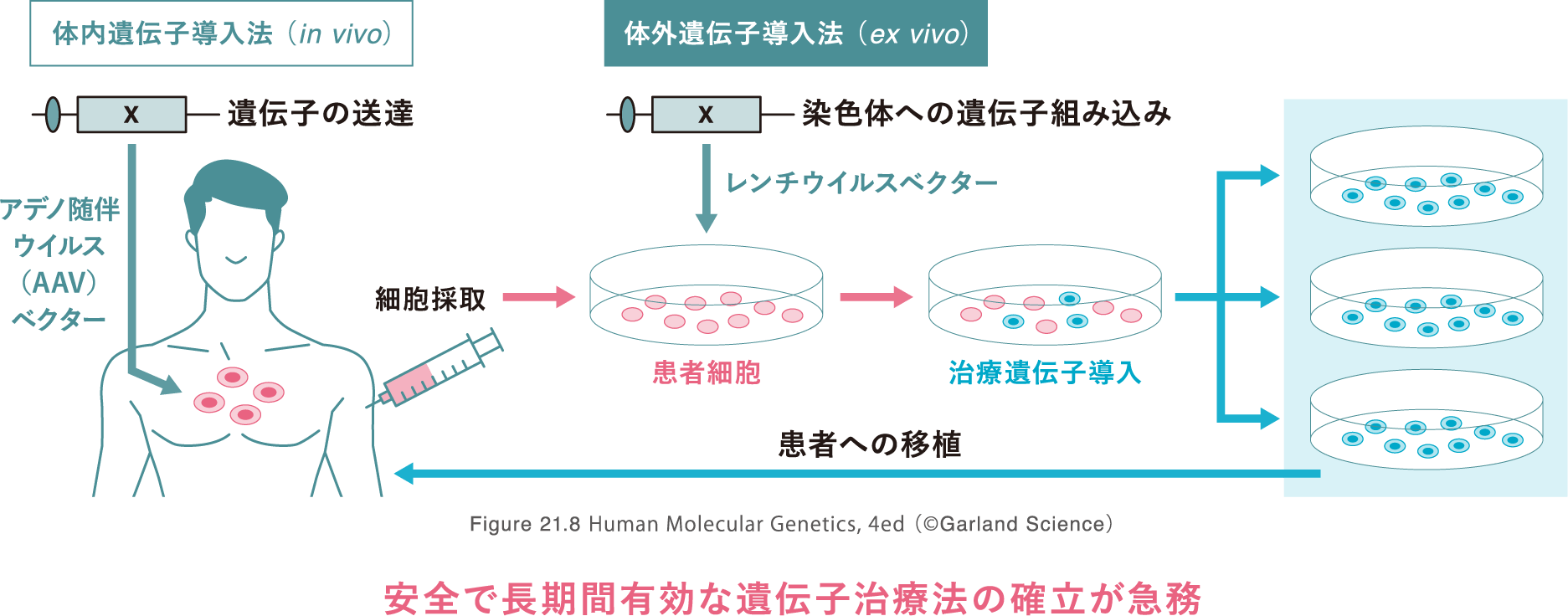
遺伝子治療の開発研究
「先天性疾患に対する
遺伝子治療の開発」
「AAVベクター基盤技術の開発」
AAVワクチンの開発研究
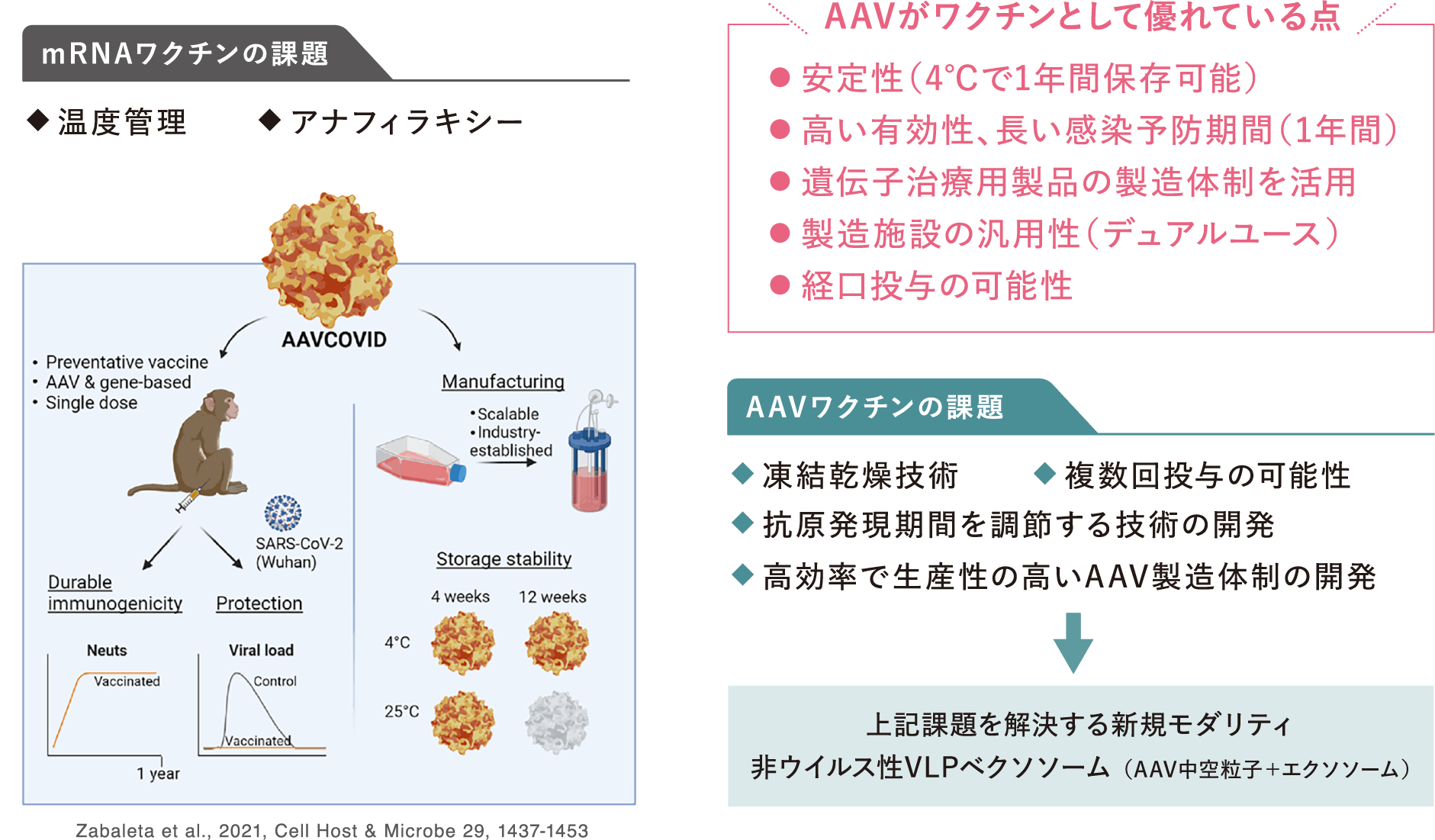
「AAVワクチンの特徴と課題」
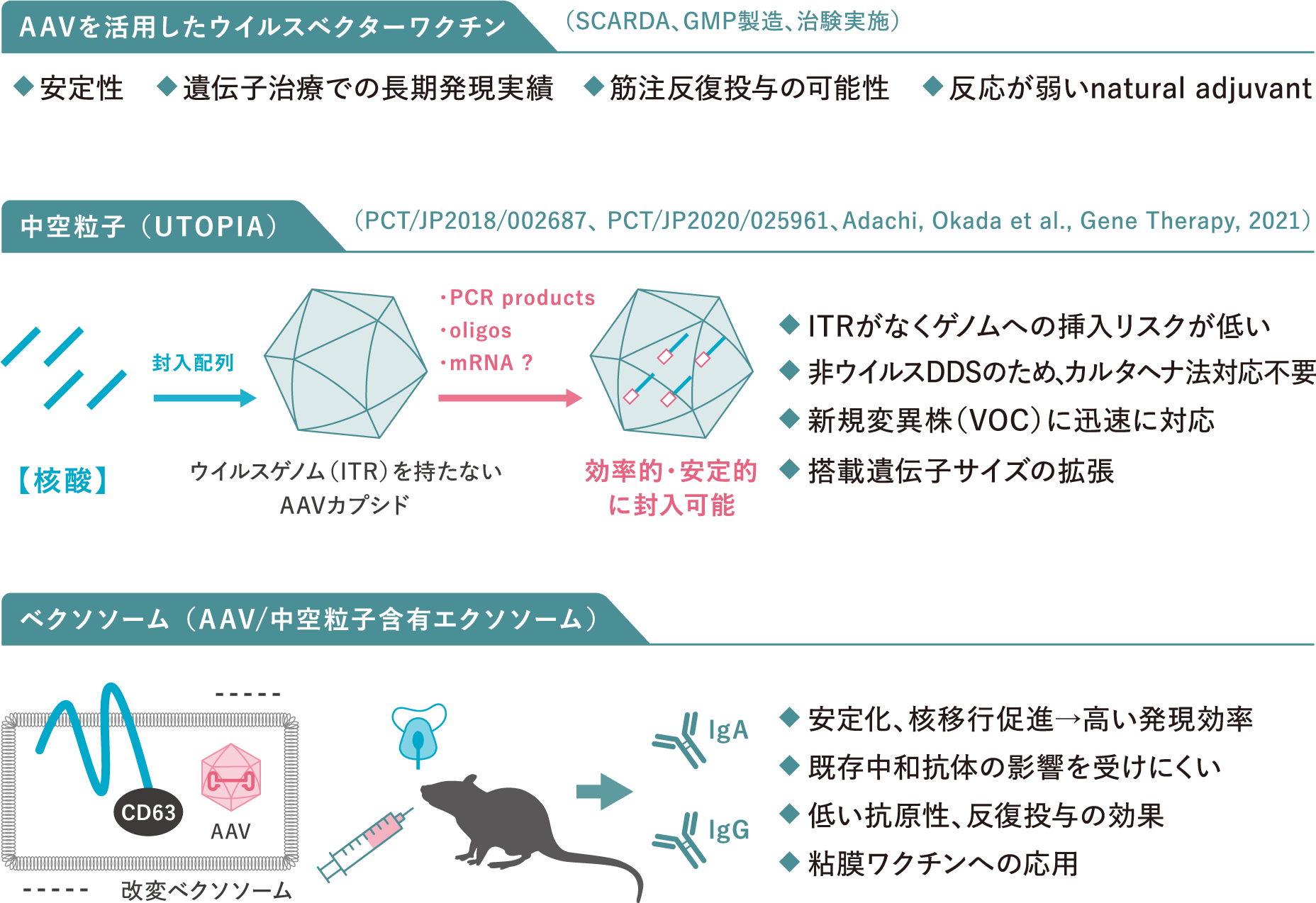
「AAV関連技術を活用した
次世代ワクチンの開発」
-
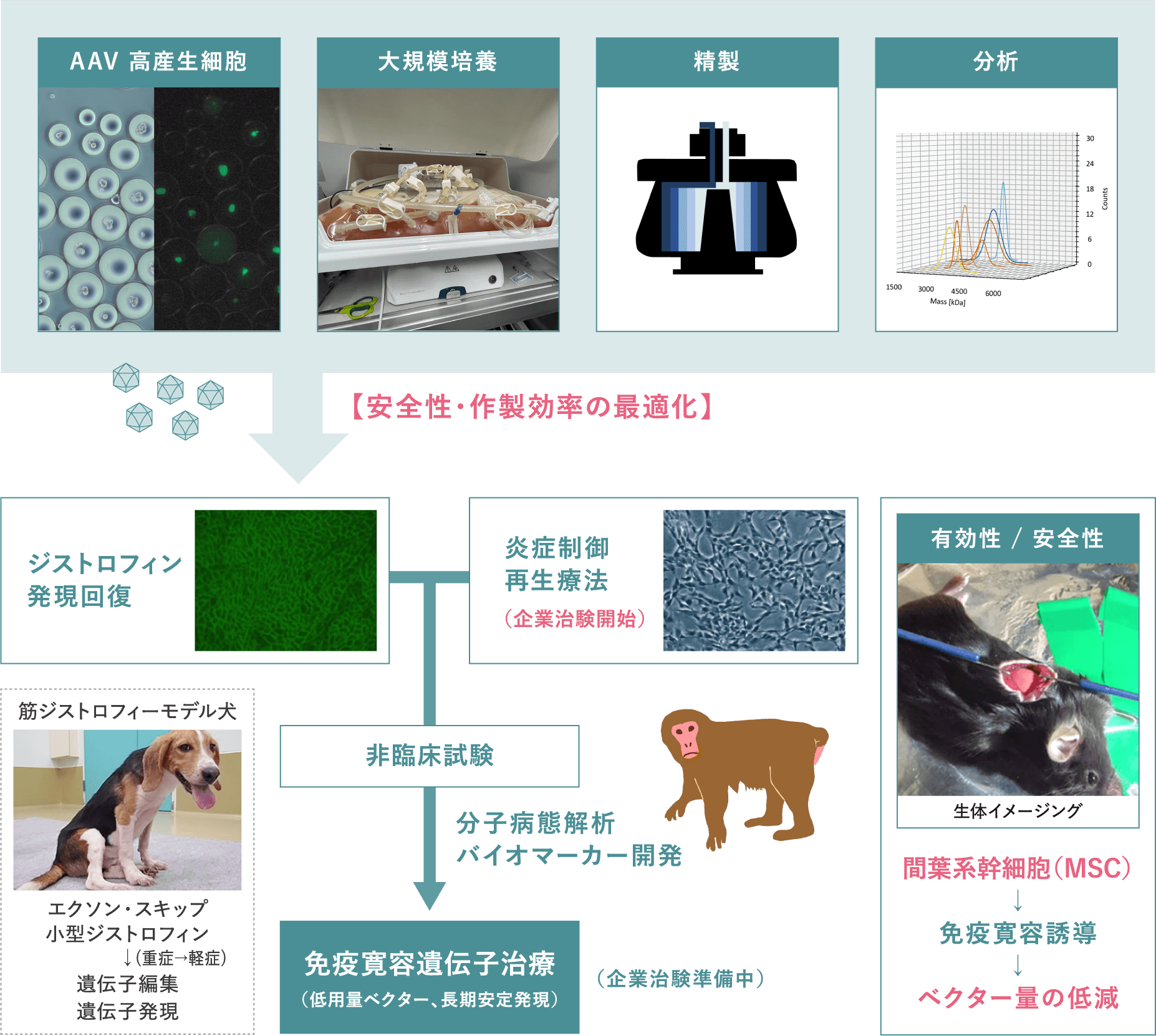
安全性が高く長期発現が可能なベクターとして期待されているアデノ随伴ウイルス(AAV)ベクターの遺伝子治療用製品としての本格的実用化に向け、新規変異体の開発や製造・精製に関する基盤技術の開発を推進しています。
ベクター製造に必要なホスト細胞として機能強化型細胞を開発し、バイオリアクターを用いた発現培養法の検討や細胞培養液上清に分泌されたウイルス粒子の分析を行っています。精製法に関しては、新規超遠心分離技術の開発に加え、目的に応じて、限外ろ過、硫安沈殿、イオン交換、ゲルろ過、疎水クロマトを組み合わせたプロセス開発を推進しています。中間体や中空粒子の混入が少ない高品質のベクターを安定的に製造するため、分析超遠心装置やクライオ電子顕微鏡を活用し、FDAや国内の規制指針の動向を反映した次世代の分析技術の開発を推進しています。
また、AAVベクターの関連技術として、ウイルスゲノムを含まない中空粒子を応用した非ウイルス性DDSの開発を行っています。新規カプシド変異体の機能解析を進めると同時に、プラスミド、DNA断片や人工核酸を中空粒子に封入あるいは結合させる技術を開発し、核酸医薬への応用を提案しています。
-
ベクター関連技術の遺伝子・細胞治療への応用として、難治性神経筋疾患に対する治療法の開発を行っています。根本的治療法がないデュシェンヌ型筋ジストロフィーの治療法の開発に向け、小型ジストロフィンの有効性や、免疫寛容誘導処置による持続的な遺伝子発現方法について、マウスおよびイヌの疾患モデル動物や霊長類を用いて安全性と有効性を検証しています。
-
病態や遺伝的素因によっては、幹細胞治療、あるいは遺伝子治療と幹細胞治療との組み合わせが適切と考えられる場合があり、遺伝子治療と併行して細胞治療技術の開発を推進しています。デュシェンヌ型筋ジストロフィーや急性期の脳梗塞における幹細胞治療の安全性や有効性を疾患モデル動物にて証明し、治験に向けた取り組みを推進しています。
-
臨床試験において病態評価に必要とされるバイオマーカーを探索するために、デュシェンヌ型筋ジストロフィーのモデル動物を用いて網羅的解析を行い、候補物質を多数同定しています。遺伝子・細胞治療の治験に臨床研究を組み合わせ、実用化を目指します。
-
今回のSARS-COV-2を契機に、今後脅威となりうる感染症に対応するため、日本医療研究開発機構(AMED)において先進的研究開発戦略センター(SCARDA)が立ち上げられました。ワクチン・新規モダリティ研究開発事業、および世界トップレベル研究開発拠点(フラッグシップ拠点)形成事業が開始され、私たちもその枠組みの中で研究を進めています。
独自のAAVベクター関連技術を、”次世代型AAVワクチンモダリティ(創薬手法)”として応用し、安全性と有効性を兼ね備えた各種感染症や神経変性疾患に対するワクチンの実用化を目指します。AAVベクターは安定性や高い免疫獲得効果から優れたワクチンモダリティとして期待されています。さらに、中和抗体を回避する効率的な遺伝子発現法を開発し、新たな核酸ワクチンの開発を推進します。
治験用ウイルスベクターワクチンの製造が可能な小規模GMP製造施設の運用においては、平時は遺伝子治療用ベクターを研究・製造する施設として稼働させ、最新技術やエビデンスを集積し、感染症有時には迅速・機動的な早期ワクチン産生施設として運用を推進します。
-
がんに集積する性質を有する幹細胞を活用し、ベクター産生型腫瘍標的細胞を開発しました。全身投与した細胞は、がんに集積し、さらにその後治療遺伝子の増幅を行うため、従来の抗がん剤治療や放射線治療では効果が期待できない浸潤病変や転移巣における治療効果が期待されます。
-
近年、白血病をはじめとする難治性血液がんに対し、ex vivo遺伝子治療の一つである”キメラ抗原受容体(CAR)T細胞療法”が承認され、臨床での使用例も増加してきています。CAR-T細胞は、CAR遺伝子の導入により、白血病細胞に結合し殺傷できる能力を与えられたT細胞です。現在のCAR-T療法は、患者さんから取り出したT細胞にCAR遺伝子を導入した後、患者さんに戻す自家移植ですが、CAR遺伝子の導入の際”レンチウイルスベクター”の使用が主流になっています。我々は、これまでの白血病やがんの研究で培ってきたレンチウイルスベクターの応用技術を活用し、CAR遺伝子を利用した次世代のがん治療法の開発に取り組んでいます。また、遺伝病に対するin vivo遺伝子治療においても、導入遺伝子の長期間の安定発現が可能なレンチウイルスベクターが注目されています。当研究室では、体内投与が可能なレンチウイルスベクターの製造法について、AAV製造法開発の経験を活かしながら開発を進めています。